Tuul Sepa Tasmaania kukkurkuradi loole jätkuks ka üks “käed külge” kogemus! Tartu Ülikooli bio- ja siirdemeditsiini instituudi füsioloogia osakonna doktorant Triin Tekko kirjutab tegemistest kuradite rohkes Tasmaanias:
Seni on mul kõige lähemad zooloogia-alased kokkupuuted olnud hiirtega, keda kasutan igapäevases teadustöös Tartu Ülikooli bio- ja siirdemeditsiini instituudi füsioloogia osakonnas, aga üheks unistuseks on pikka aega olnud kukkurkuradite uurimine. Kukkurkuradid (Sarcophilus harrisii) elavad tänapäeval ainult Tasmaanias ja pärast kukkurhundi väljasuremist on nad suurimad lihatoidulised kukkurloomad. Kahjuks võib nende enda populatsiooni samuti ähvardada väljasuremine, kuna neil levib haigus nimega Tasmanian Devil Facial Tumour Disease (DFTD), loomariigis haruldane nakkav vähk [Pearse jt., 2012; McCallum jt., 2009]. DFTD levib hammustuste teel, millega vähirakud satuvad haige kuradi organismist tervesse kuradisse ning hakkavad seal vähirakkudele kohaselt vohama, põhjustades kasvajate teket näopiirkonnas [Pearse ja Swift, 2006]. Nakatunud kuradid elavad haigusega tavaliselt kuni 6 kuud ja surevad elundite ülesütlemise või nälgimise tõttu [Hamede jt., 2012; McCallum jt., 2009].

Põhjuseid, miks just kukkurkuraditel nakkav vähivorm esineb, on mitu. Aegade jooksul on nende populatsioon läbinud mitu geneetilist pudelikaela ehk perioodi, mille jooksul ainult väike osa geneetilisest varieeruvusest järgmistele põlvkondadele edasi kantakse. Nende pudelikaelte põhjuseks peetakse kliima äkilisi jahenemisi ja kuivenemisi ning loomade massilist küttimist pärast valgete asukate saabumist [Miller jt., 2011; Brüniche-Olsen jt., 2014]. Ka DFTD ise on tekitanud uue pudelikaela, kuna on mõnedes piirkondades vähendanud kukkurkuradite arvukust rohem kui 90% võrra [Lachish jt., 2007]. Geneetiliste pudelikaelade tagajärjeks on see, et kukkurkuradite immuunsüsteemi geenide varieeruvus on väga väike [Siddle jt., 2007]. Kasvajarakud kasutavad immuunsüsteemi eest põgenemiseks põhilise koesobivuskompleks I (Major histocompatibility complex I e MHCI) valkude ekspressiooni vähendamist oma rakkude pinnal [Siddle jt., 2013]. MHCI valgud paiknevad peaaegu kõikide keharakkude pinnal ja aitavad immuunsüsteemil oma keha rakke ära tunda ning eristada neid võõrastest. DFTD puhul ei tunne tsütotoksilised T-lümfotsüüdid kasvajarakke ära ja selle tõttu ei teki immuunvastust [Siddle jt., 2013].
Veel üks põhjus, miks nakkav vähk just kukkurkuraditel levib, peitub nende äärmiselt agressiivses käitumises. Loomade omavahelised kokkupuuted on hammustusterohked, eriti vägivaldsed on paaritumiskombed. Paaritumise ajal on isastel kombeks emased urgu tirida ja seal vangis pidada, see on saadetud karjumisest ja hammustamistest ning ilmselt sealt on tulnud ka kuradi nimi. Just paaritumisperioodil, mis kestab märtsist maini, toimub suurem osa nakatumistest [Jones jt., 2008].
DFTD avastati esmakordselt 1996. aastal Tasmaania kirdeosas ja sellest ajast alates on haigus levinud peaaegu üle kogu saare [Hawkins jt,. 2006, Epstein jt., 2016].
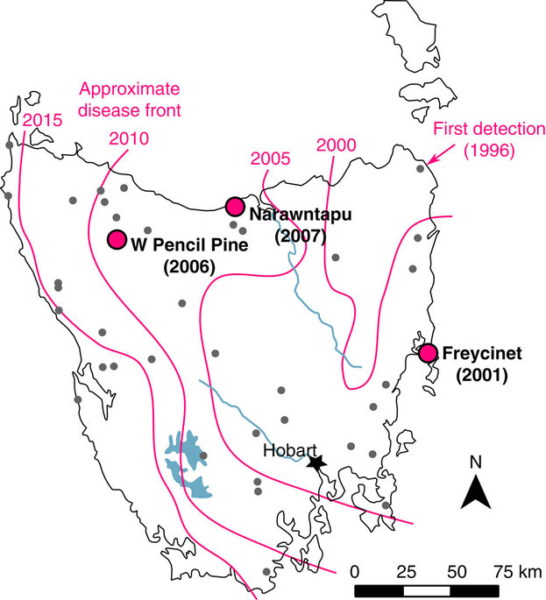
Hiljuti on leitud, et mõned kasvajatega võitlemisega seotud genoomi piirkonnad on tugeva valikusurve mõju all 4 – 6 põlvkonna jooksul väga kiirelt evolutsioneerunud [Epstein jt., 2016] ning üksikutel kukkurkuraditel on ikkagi tekkinud kasvajarakkude vastu immuunvastus [Pye jt., 2016a]. Samas on võidujooks immuunsüsteemi ja vähi vahel viinud ka DFTD pideva muteerumiseni [Pearse jt., 2012; Hamede jt., 2015; Murchison jt., 2012]. Mõned aastad tagasi leiti kukkurkuraditel ka teine nakkav näovähivorm, mis sai nimeks DFT2 [Pye jt., 2016b]. Esimene vähivorm, DFT1, on pärit ühelt rohkem kui 20 aastat tagasi elanud emaselt loomalt ja sellega sümptomitelt sarnane DFT2 ühelt hiljuti elanud isaselt kuradilt [Murchison jt., 2012; Pye jt., 2016]. DFTD-d uurivad erinevate nurkade alt paljud erinevad teadusgrupid mitmetest ülikoolidest. Proovitakse välja töötada vaktsiini ja tekitatakse haigusest vabasid isoleeritud populatsioone ning üritatakse omavahel paaritada geneetiliselt erinevamaid isendeid. Kas ja mil määral need ettevõtmised kukkurkuradite käekäiku parandavad, näitab tulevik.
Ma osalesin vabatahtlikuna Tasmaania Ülikooli teadlase Rodrigo Hamede teadusgrupis, aidates ta tudengit Samantha James`i kukkurkuradite lõksupüügil. Lõksupüük toimus veebruarikuus Tasmaania läänepoolses osas Cradle Mountain`i rahvuspargis West Pencil Pine`i uurimisalal, kus on kuradeid seiratud juba kümme aastat. Umbes 25 km2 suurusele alale pannakse kümneks ööks üles 40 söödaga lõksu, mida igal hommikul kontrollitakse. Kinnipüütud kukkurkuradid kiibistatakse ja mõõdetakse üle ning neilt võetakse erinevaid proove, protseduuride järel lastakse loomad samasse kohta tagasi. Vere-, kasvaja-, karva-, vurru- ja kakaproovid läksid erinevatesse laboritesse teadlastele uurimiseks. Samantha enda projektiks on kirjeldada DFT1 ja DFT2 levikut nendel aladel, mida veel põhjalikult uuritud ei ole.



















DFTD uurimisele saab erinevatel viisidel kaasa aidata igaüks. Save the Tasmanian Devil projekti kaudu kogutakse nii annetusi kui otsitakse vabatahtlikke välitöödele. Projekti koduleht asub aadressil http://www.tassiedevil.com.au/tasdevil.nsf
Hoiatuseks ütlen ainult, et tegu on sõltuvust tekitavalt armsate loomadega ja juba vanarahvas teadis, et annad kuradile sõrme, võtab käe – mul on juba maikuus järgmine välitöösessioon plaanis.
Fotod: Triin Tekko erakogu ja http://animals.sandiegozoo.org/animals/tasmanian-devil
Viited
Brüniche-Olsen, A. jt. 2014. Extensive population decline in the Tasmanian devil predates European settlement and devil facial tumour disease. Biol Lett. 10(11):20140619.
Epstein, B. jt. 2016. Rapid evolutionary response to a transmissible cancer in Tasmanian devils. Nat Commun.7, 12684.
Hamede, R. jt. 2012. Reduced effect of Tasmanian devil facial tumor disease at the disease front. Conserv. Biol. J. Soc. Conserv. Biol. 26, 124–134.
Hamede, R. jt. 2015. Transmissible cancer in Tasmanian devils: localized lineage replacement and host population response. Proc. Biol. Sci. 282, 20151468.
Hawkins, C.E. jt. 2006. Emerging disease and population decline of an island endemic, the Tasmanian devil Sarcophilus harrisii. Biol. Conserv. 131, 307–324.
Jones, M. E. jt. 2008. Life-history change in disease-ravaged Tasmanian devil populations. Proc. Natl Acad. Sci. USA 105(29):10023-10027.
Lachish S. jt. 2007. The impact of disease on the survival and population growth rate of the Tasmanian devil. J. Anim. Ecol. 76, 926–936.
McCallum, H. jt. 2009. Transmission dynamics of Tasmanian devil facial tumor disease may lead to disease-induced extinction. Ecology 90, 3379–3392.
Miller, W. jt. 2011. Genetic diversity and population structure of the endangered marsupial Sarcophilus harrisii (Tasmanian devil). Proc. Natl Acad. Sci. USA 108, 12348–12353.
Murchison, E. P. jt. 2012. Genome Sequencing and Analysis of the Tasmanian Devil and Its Transmissible Cancer. Cell 148(4): 780–791.
Pearse, A. M. ja Swift, K. 2006. Allograft theory: transmission of devil facial-tumour disease. Nature 439, 549.
Pearse, A. M. jt. 2012. Evolution in a transmissible cancer: a study of the chromosomal changes in devil facial tumor (DFT) as it spreads through the wild Tasmanian devil population. Cancer Genet. 205, 101–112.
Pye, R. jt, 2016a. Demonstration of immune responses against devil facial tumour disease in wild Tasmanian devils. Biol Lett. 12(10).
Pye, R. J. jt. 2016b. A second transmissible cancer in Tasmanian devils. Proc. Natl. Acad. Sci. USA 113, 374–379.
Siddle, H. V. jt. 2007. Transmission of a fatal clonal tumor by biting occurs due to depleted MHC diversity in a threatened carnivorous marsupial. Proc. Natl. Acad. Sci. USA 104(41):16221-16226.
Siddle, H. V. jt. 2013. Reversible epigenetic down-regulation of MHC molecules by devil facial tumour disease illustrates immune escape by a contagious cancer. Proc. Natl. Acad. Sci. USA 110, 5103–5108.